MEKANISME REAKSI SUBSTITUSI NUKLEOFILIK SN2
MEKANISME REAKSI
SUBSTITUSI NUKLEOFILIK SN2
REAKSI SUBSTITUSI
Kata dari Substitusi pasti sudah tidak asing lagi bagi
kawan-kawan sekalian bukan? Apa itu substitusi? Reaksi Substitusi? Jika kita
menelusuri terlebih dahulu apa itu substitusi, menurut pencarian APAARTI.COM yakni penggantian
atom atau gugus atom dalam suatu molekul oleh atom atau gugus atom lain. Oleh
karena itu. Bisa disimpulkan bahwa reaksi substitusi adalah reaksi penggantian atom atau
gugus atom oleh atom atau gugus atom lain.
Jadi dalam reaksi substitusi suatu atom atau gugus
atom yang terdapat dalam rantai utama akan meninggalkan rantai utama tersebut
dan tempatnya yang kosong akan diganti oleh atom atau gugus atom yang lain.
Berdasarkan pereaksi yang yang dipergunakan, reaksi
substitusi dapat dibedakan menjadi (a) reaksi substitusi radikal bebas; (b)
reaksi substitusi nukleofilik; dan (c) reaksi substitusi elektrofilik.
Reaksi
substitusi juga dapat diartikan sebagai reaksi dimana berlangsung
penggantian ikatan kovalen pada suatu atom karbon. Reagensia pengganti dan
gugus lepas yang meninggalkan substrat dapat berupa nukleofil atau elektrofil
(atau radikal bebas). Secara umum, reaksinya dapat dinyatakan sebagai
berikut:
Reaksi secara umum:
R - H + X2
→ R – X + H – X
Alkana halogen haloalkana
asam klorida
·
Contoh:
CH3-CH3 (g) + Br2 (g) → CH3-CH2-Br
(g) + HBr (g)
Etana
gas Brom bromoetana
asam Bromida
1.
Reaksi Substitusi Radikal Bebas,
Radikal bebas merupakan atom atau grup atom yang memiliki
sebuah elektron tidak berpasangan/ bebas. Reaksi substitusi radikal bebas
merupakan reaksi yang berhubungan dengan radikal bebas. Radikal
bebas dibentuk jika ikatan terbelah menjadi dua yang sama - sehingga setiap
atom mendapat satu dari dua elektron yang dipakai untuk berikatan. Disebut juga
sebagai pembelahan homolitik.
Untuk menunjukkan
sesuatu (atom atau grup atom) merupakan radikal bebas, dituliskan dengan simbol
titik untuk menunjukkan elektron yang tidak berpasangan.
2
Reaksi substitusi elektrofilik adalah reaksi kimia di
mana suatu elektrofil menggantikan sebuah gugus fungsional dalam
suatu senyawa, yang biasanya, tapi tidak
selalu, merupakan atom hidrogen. Reaksi substitusi elektrofilik aromatik merupakan
ciri khas dari senyawa aromatik,
serta merupakan cara penting untuk memasukkan gugus fungsional ke dalam
cincin benzena. Jenis utama lain dari reaksi
substitusi elektrofilik merupakan reaksi
substitusi elektrofilik alifatik.
3.
Reaksi Substitusi Nukleofilik
Pada kimia organik,
substitusi nukleofilik adalah suatu kelompok dasar reaksi sustitusi, dimana sebuah
nukleofil yang "kaya" elektron, secara selektif berikatan dengan atau
menyerang muatan positif dari sebuah gugus kimia atau atom yang disebut dengan
gugus lepas (leaving group)
Bentuk umum reaksi ini
adalah
Nu: + R-X →
R-Nu + X:
Dengan Nu menandakan
nukleofil: menandakan pasangan elektron, serta R-X menandakan substrat dnegan
gugus pergi X. Pada reaksi tersebut, pasangan elektron dari nukleofil menyerang
substrat membentuk ikatan baru, sementara gugus pergi melepaskan diri bersama
dengan sepasang elektron. Produk utamanya adalah R-Nu. Nukleofil dapat memiliki
muatan listrik negatif ataupun netral, sedangakn susbstrat biasanya netral atau
bermuatan positif.
Contoh substitusi
nukleofilik adalah hidrolisis alkil bromida, R-Br, pada kondisi basa, dimana
nukleofilnya adalah OH dan gugus perginya adalah Br
R-Br + OH− → R-OH +
Br−
Reaksi substitusi nukleofilik sangat umum dijumpai
pada kimia organik, dan reaksi-reaksi ini dapat dikelompokkan sebagai reaksi
yang terjadi pada karbon alifatik, atau pada karbon aromatik atau karbon tak
jenuh lainnya (lebih jarang).
Lebih
jauh lagi, reaksi substitusi selanjutnya digolongkan kedalam dua golongan yang
“disebut-sebut” sebagai reaksi SN1 dan SN2.
Contoh masing-masing reaksi adalah:
Mekanisme Reaksi Substitusi Nukleofilik Pada dasarnya
terdapat dua mekanisme reaksi substitusi nukleofilik. Mereka dilambangkan
dengan SN2 adan SN1. Bagian SN menunjukkan substitusi nukleofilik, sedangkan
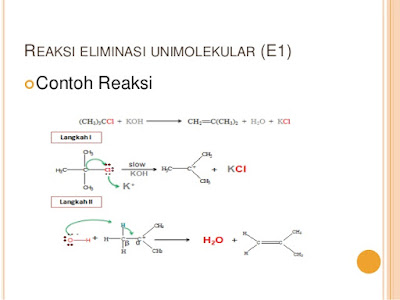
arti 1 dan 2 akan dijelaskan kemudian. A. Reaksi SN2 Mekanisme SN2 adalah proses
satu tahap yang dapat dijelaskan sebagai berikut:
Ikatan C-X
akan diserang nukleofil dari arah belakang. Pada keadaan transisi, nukleofil
dan gugus pergi berasosiasi dengan karbon di mana substitusi akan terjadi. Pada
saat gugus pergi terlepas dengan membawa pasangan elektron, nukleofil
memberikan pasangan elektronnya untuk dijadikan pasangan elektron dengan
karbon. Notasi 2 menyatakan bahwa reaksi adalah bimolekuler, yaitu nukleofil
dan substrat terlibat dalam langkah penentu kecepatan reaksi dalam mekanisme
reaksi.
Adapun ciri reaksi SN2 adalah:
1. Karena nukleofil dan substrat terlibat dalam
langkah penentu kecepatan reaksi, maka kecepatan reaksi tergantung pada
konsentrasi kedua spesies tersebut.
2. Reaksi terjadi dengan pembalikan (inversi)
konfigurasi. Misalnya jika kita mereaksikan (R)-2-bromobutana dengan natrium
hidroksida, akan diperoleh (S)-2-butanol.Ion hidroksida menyerang dari belakang
ikatan C-Br. Pada saat substitusi terjadi, ketiga gugus yang terikat pada
karbon sp3 kiral itu seolah-olah terdorong oleh suatu bidang datar sehingga
membalik. Karena dalam molekul ini OH mempunyai perioritas yang sama dengan Br,
tentu hasilnya adalah (S)-2-butanol. Jadi reaksi SN2 memberikan hasil inversi.
3. Jika substrat R-L bereaksi melalui mekanisme SN2,
reaksi terjadi lebih cepat apabila R merupakan gugus metil atau primer, dan
lambat jika R adalah gugus tersier. Gugus R sekunder mempunyai kecepatan
pertengahan. Alasan untuk urutan ini adalah adanya efek rintangan sterik.
Rintangan sterik gugus R meningkat dari metil < primer < sekunder <
tersier. Jadi kecenderungan reaksi SN2 terjadi pada alkil halida adalah: metil
> primer > sekunder >> tersier.
PERMASALAHAN :
1. Perbedaan apa saja yang terdapat antara mekanisme
reaksi substitusi SN2 dengan SN1?
2. Apa saja yang membedakan dari reaksi substitusi
radikal bebas, reaksi substitusi nukleofilik, dan reaksi substitusi
elektrofilik.
3. Mengapa jika subtrat
R-L, reaksi akan lebih cepat jika R merupakan gugus metil atau primer dan
lambat jika R merupakan gugus tersier? Mohon penjelasannya.

Saya ira desmila nim A1C117010 akan mencoba menjawab permasalahan no 3.
BalasHapusPada dasarnya terdapat urutan dalam kecepatan suatu reaksi, Alasan untuk urutan ini adalah adanya efek rintangan sterik. Rintangan sterik gugus R meningkat dari metil kemudian primer kemudian sekunder dan yang terakhir tersier. Dapat kita ketahui Jadi kecenderungan reaksi SN2 terjadi pada alkil halida yaitu metil > primer > sekunder > tersier.
Saya Neng early Oktavia
BalasHapusNim A1C117044
Akan coba menjawab permasalahan no 1
Perbedaan mekanisme Reaksi Sn1 dan Sn2
1. Mekanisme reaksi Sn1
- nukleofil lemah
- substrat yang digunakan berupa alkil halida tersier, dapat pula menggunaka alkil halida sekunder tetapi harus ada pelarut yang mendukung
- pelarus yang digunakan pelarut polar protik seperti air dan asam karboksilat
- kinetika reaksi orde pertama
- produk yang dihasilkan campuran stereokimia S dan R
- sering terjadi pengaturan kembali struktur setelah reaksi
2. Mekanisme Reaksi Sn2
- nukleofil harus kuat
- substrat yng digunakan berupa alkil halida primer, dapat pula alkil halida sekunder
- pelarut yang digunakan adalah pelarut polar aprotik seperti aseton
- kinetika reaksi Orde kedua
- produk berupa 100% stereokimia kebalikan dari produk
- tidak mungkin terjadi penataan kembali struktur setelah bereaksi
Assalamualaikum wr wb.
BalasHapusSaya Ariyansyah
NIM A1C117050
Saya akan membantu menjawab permasalahan no.2
1. Reaksi substitusi radikal bebas terjadi apabila Pereaksi radikal bebas adalah atom atau gugus atom yang mengandung sebuah elektron yang tidak berpasangan.
2. Reaksi substitusi nukleofilik terjadi apabila gugus yang mengganti merupakan pereaksi nukleofil (HO-).
3. Reaksi substitusi elektrofilik merupakan reaksi pergantian elektrofil. Elektrofil merupakan kebalikan dari nukleofil. Elektrofil merupakan spesi yang tertarik pada muatan negatif. Jadi elektrofil merupakan suatu asam Lewis (H+).